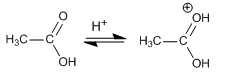
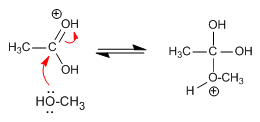
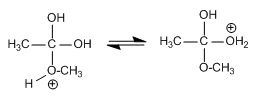
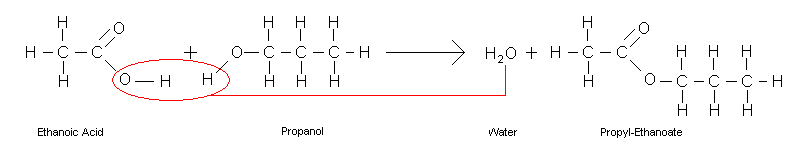
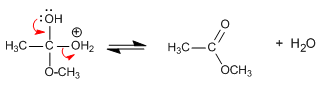El agua es el líquido que más sustancias disuelve, por eso decimos que es el disolvente universal. Esto se debe a su capacidad para formar puentes de hidrógeno con otras sustancias que pueden presentar grupos polares o con carga iónica (alcoholes, azúcares con grupos R-OH, aminoácidos y proteínas con grupos que presentan cargas positivas y negativas), lo que da lugar a disoluciones moleculares. También las moléculas de agua pueden disolver a sustancias salinas que se disocian formando disoluciones iónicas.
Entre un 55 y un 75% del peso del cuerpo humano está formado por agua. Este porcentaje varía según la edad, a mayor edad menos proporción, y según el sexo, en el hombre es mayor que en las mujeres.
El agua corporal se distribuye en distintos compartimentos intracelulares y extracelulares. La extracelular supone el 20% del peso corporal, esta a su vez se divide en intersticial, el 15% y en circulante, en el plasma y la linfa un 5%, que destaca por su contenido en proteínas, y el agua intracelular que supone entre el 35 y el 55%, y apenas contiene proteínas.
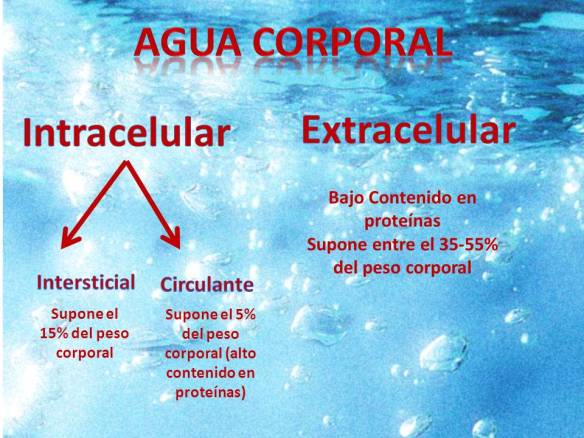
La diferencia entre el agua extracelular y el agua intracelular es su composición. El agua extracelular contiene sobre todo iones de sodio, cloro, calcio, carbonato, etc. Mientras que la intracelular es rica en fosfatos, sulfatos, magnesio, potasio, etc.

Desde el punto de vista químico, podemos decir que es una sustancia inorgánica compuesta por dos moléculas de hidrógeno y una de oxígeno H2O. Es una sustancia bastante común en el universo y en el sistema solar, donde se encuentra principalmente en forma de vapor o de hielo. Es esencial para la supervivencia de todas las formas conocidas de vida.
Dada su importancia para la vida humana es considerada como un nutriente más y lo encontramos distribuido en los alimentos en diferentes proporciones. Sus propiedades como disolvente posibilitan las diversas reacciones químicas de los compuestos orgánicos cruciales para todas las funciones vitales, el transporte de moléculas a través de las membranas y para disolver los productos de excreción. Es un agente activo esencial en muchos de los procesos metabólicos de los seres vivos. La extracción de agua de las moléculas, mediante las reacciones químicas enzimáticas que consumen energía, permiten la síntesis de macromoléculas complejas, como los triglicéridos o las proteínas, y reduciendo el tamaño de moléculas como la glucosa, los ácidos grasos y los aminoácidos, produciendo energía en el proceso.
La oxidación de los lípidos o hidratos de carbono, genera cierta cantidad de agua; sin embargo, el agua metabólica es insuficiente para compensar las pérdidas a través de la orina, las heces, el sudor, o por exhalación del aliento, por lo que para mantener el balance hídrico del cuerpo es necesario consumir agua. Podemos obtener agua tanto de las bebidas líquidas como de los alimentos, entre los cuales destacan las frutas y las verduras frescas por contener el mayor porcentaje, hasta un 85 %, similar al de muchas bebidas, mientras que los cereales o los frutos secos suelen componerse solo de un 5 % de agua.

El agua desempeña un papel crucial en la tecnología de los alimentos y es un elemento básico en el procesamiento de alimentos, influyendo en la calidad de estos. Algunos métodos populares utilizados en la cocción de los alimentos son; la ebullición, la cocción al vapor y el hervor a fuego lento. Estos procedimientos culinarios requieren de la inmersión de los alimentos en el agua cuando esta se encuentra en estado líquido o de vapor.