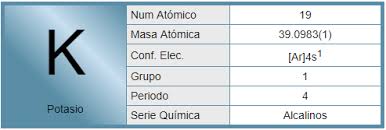
El potasio de símbolo K, es un elemento químico de número atómico 19, masa atómica 39,09 y valencia 1. Es un metal alcalino de color blanco plateado, que abunda en la naturaleza en los elementos relacionados con el agua salada y otros minerales. Se oxida rápidamente en el aire, es muy reactivo, especialmente en agua y se parece químicamente al sodio. Es un elemento químico esencial.
Es el quinto metal más ligero y liviano, es un sólido blando que se corta con facilidad con un cuchillo, tiene un punto de fusión muy bajo (63,5 °C), arde con llama violeta y presenta un color plateado en las superficies expuestas al aire, en cuyo contacto se oxida con rapidez, lo que obliga a almacenarlo recubierto de aceite.
Al igual que otros metales alcalinos reacciona violentamente con el agua desprendiendo hidrógeno, incluso puede inflamarse espontáneamente.
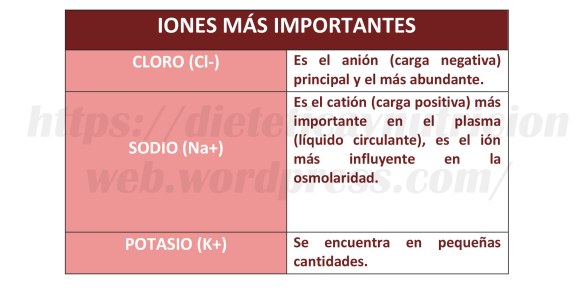
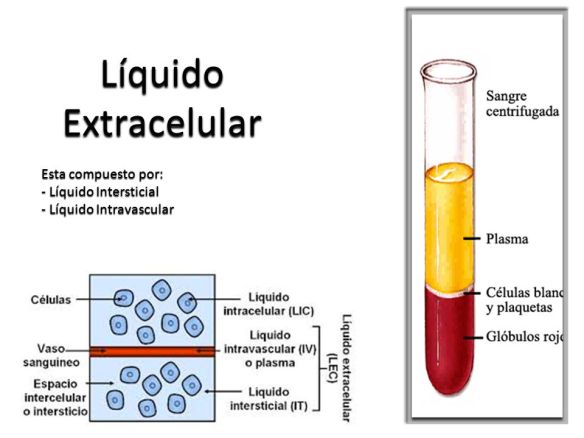
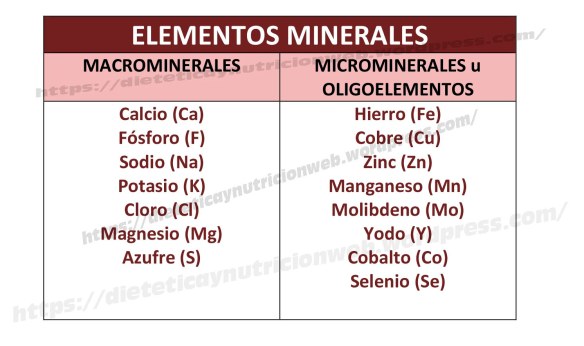
Es el tercer elemento más abundante en nuestro cuerpo y es un mineral esencial que debe estar presente para diversos procesos de nuestro organismo.
Compuestos Químicos
Junto con el cloro (Cl-), forma el compuesto químico cloruro de potasio (KCl), que se utiliza en medicina, aplicaciones científicas y en el procesamiento de alimentos. La mayoría del cloruro de potasio producido se utiliza en la fabricación de fertilizante, ya que el crecimiento de muchas plantas está limitado por el consumo de potasio.
Funciones
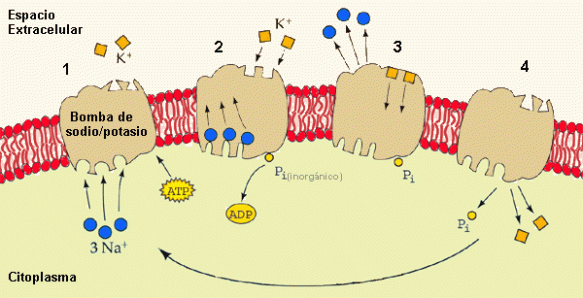
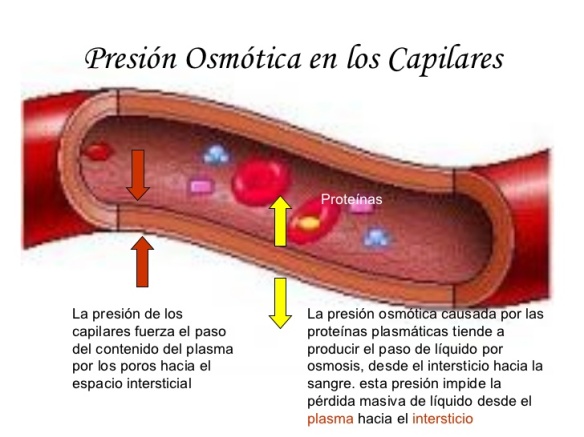
El potasio facilita la progresión del impulso nervioso y muscular, participando en la contractilidad cardiaca, al participar en la transmisión del impulso nervioso a través de los potenciales de acción del organismo humano. También regula el equilibrio de agua dentro y fuera de las células y debido a su naturaleza con propiedades electrostáticas y químicas, los iones de potasio son más pequeños que los iones de sodio, por lo que los canales iónicos y las bombas de las membranas celulares pueden distinguir entre los dos tipos de iones; bombear activamente o pasivamente permitiendo que uno de estos iones pase, mientras que bloquea al otro.
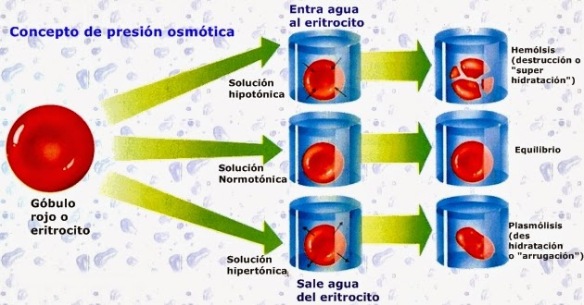
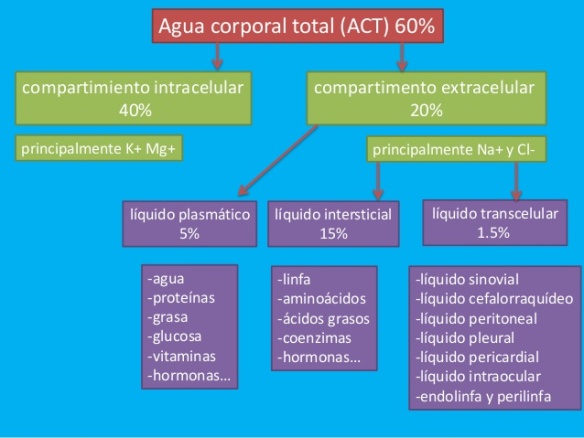
Interviene en la síntesis de proteínas, de glucógeno y en algunas reacciones del metabolismo energético como catalizador. También interviene en el equilibrio hidroeléctrico (mantenimiento normal del agua en el cuerpo) y en el equilibrio ácido básico. Es el catión mayor del líquido intracelular del organismo humano.
Necesidades
Una dieta equilibrada en potasio ayuda a reducir el riesgo de sufrir hipertensión y ayudaría a bajar la presión arterial en personas que ya sufren de esta enfermedad. Por otro lado, la falta de este mineral puede originar la aparición de diversos síntomas como pueden ser debilidad, calambres musculares, estreñimiento e incluso alteraciones en el ritmo cardíaco, pudiendo producir alteraciones en el crecimiento.
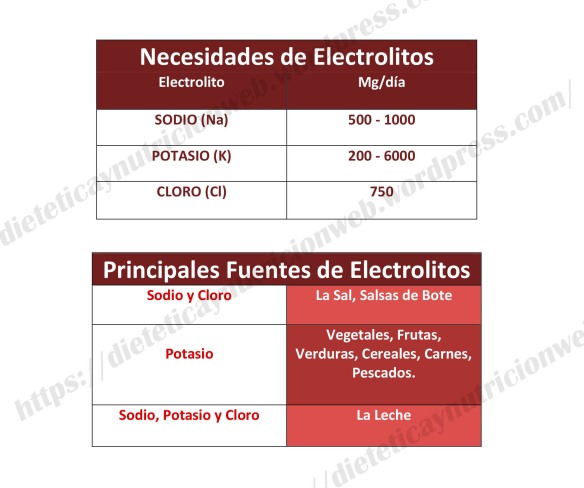
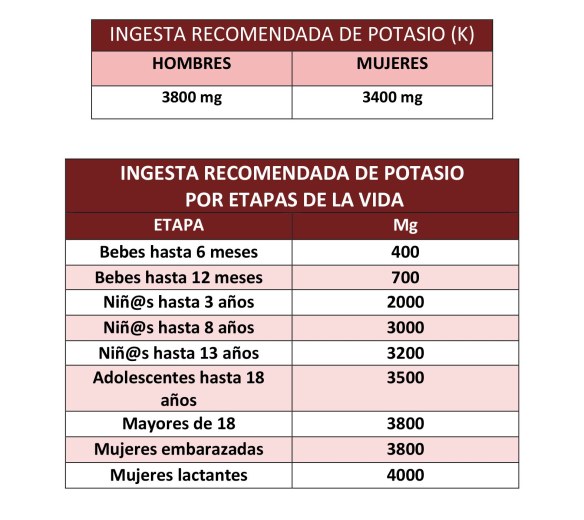
La ingesta recomendada de potasio depende de la edad y del sexo, oscilando entre los 3800mg para los hombres y los 3400mg en las mujeres. Una persona con niveles altos de sodio y bajos en potasio tiene más riesgo de sufrir hipertensión, lo que aumenta las posibilidades de ataques cardíacos y accidentes cerebrovasculares.
Fuentes
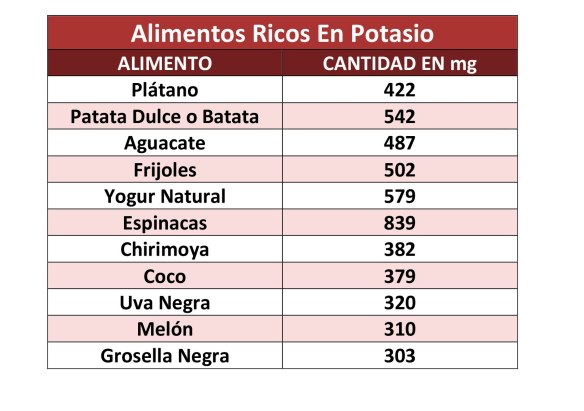
El potasio se encuentra en muchos alimentos, lo podemos encontrar naturalmente en las legumbres (lentejas, garbanzos), las espinacas, las habas, el repollo, el perejil y en frutas como las bananas, naranjas, kiwis, uvas, papayas y dátiles.
Las personas veganas o vegetarianas debido a su elevado consumo de frutas y verduras tienen mucha menos probabilidad de sufrir hipertensión.
Metabolismo
Se absorbe por difusión, se transporta de forma libre y se elimina por orina y sudor principalmente, aunque también algo por las heces.